
Con cierto efecto retardado, otra cuestión que nos deja el modelo de Bell y los de la eucariogénesis vírica en general: todos ellos implican la existencia de virus (vaya lince que soy).
Y los virus qué, ¿cómo aparecieron ellos?
'En la ciencia como en la vida el fruto viene después del amor'. Santiago Ramón y Cajal

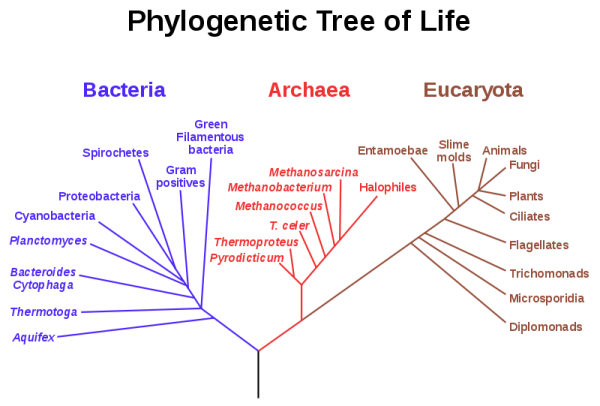 Cuando esta comparación se hace entre los distintos dominios (archaea, bacteria y eukarya) vemos una serie de características que nos dividen los tres grupos. Análisis moleculares indican que la organización celular procariota es más antigua que la eucariota, esa célula primitiva era procariota o algo parecido y luego, con el paso del tiempo, algo ocurrió que separó a un linaje que daría lugar a los eucariotas y a otro linaje que daría lugar a las arqueas (Woese et al. 1990). Y las arqueas, dentro de lo que cabe, no son muy distintas de las bacterias (que no me pegue nadie, es una simplificación) por lo que el cambio fundamental ocurrió en el otro linaje, el que daría lugar a la célula eucariota. Así, eucariotas y arqueas tendrían un ancestro común, distinto a las bacterias. Si enumeramos algunas de esas nuevas características tenemos la adición de la caperuza a ARN mensajero, que el material genético no es circular sino lineal, la membrana nuclear, la existencia de los telómeros, etc. Si nos fijamos en los seres vivos, nada se parece a los eucariotas. Pero si consideramos ser vivo a los virus... la cosa cambia, ¿no?. Si metemos en la comparación a los virus, vemos una serie de curiosas coincidencias, como que sus genomas son lineales, sus mensajeros tienen caperuza, telómero, transporte de los ácidos nucléicos (del virión a la célula en virus, del núcleo al citoplasma en eucariotas), compartimentación del genoma, etc. Características que, hasta la fecha, no explican otras hipótesis, las cuales proponen la simbiosis, previa fagocitosis, entre una arquea y una bacteria y de una simbiosis metabólica entre bacteria y arquea -sintrofia- (Gupta and Golding 1996; Margulis 1996; Ribeiro y Golding 1998; Zillig 1991; Gupta 1998; Martin and Muller 1998; Vellai et al. 1998; Moreira y Lopez-Garcia 1998; Lopez-Garcia y Moreira 1999; Lake y Rivera 1994; Sogin 1991; Cavalier-Smith 1987).
Cuando esta comparación se hace entre los distintos dominios (archaea, bacteria y eukarya) vemos una serie de características que nos dividen los tres grupos. Análisis moleculares indican que la organización celular procariota es más antigua que la eucariota, esa célula primitiva era procariota o algo parecido y luego, con el paso del tiempo, algo ocurrió que separó a un linaje que daría lugar a los eucariotas y a otro linaje que daría lugar a las arqueas (Woese et al. 1990). Y las arqueas, dentro de lo que cabe, no son muy distintas de las bacterias (que no me pegue nadie, es una simplificación) por lo que el cambio fundamental ocurrió en el otro linaje, el que daría lugar a la célula eucariota. Así, eucariotas y arqueas tendrían un ancestro común, distinto a las bacterias. Si enumeramos algunas de esas nuevas características tenemos la adición de la caperuza a ARN mensajero, que el material genético no es circular sino lineal, la membrana nuclear, la existencia de los telómeros, etc. Si nos fijamos en los seres vivos, nada se parece a los eucariotas. Pero si consideramos ser vivo a los virus... la cosa cambia, ¿no?. Si metemos en la comparación a los virus, vemos una serie de curiosas coincidencias, como que sus genomas son lineales, sus mensajeros tienen caperuza, telómero, transporte de los ácidos nucléicos (del virión a la célula en virus, del núcleo al citoplasma en eucariotas), compartimentación del genoma, etc. Características que, hasta la fecha, no explican otras hipótesis, las cuales proponen la simbiosis, previa fagocitosis, entre una arquea y una bacteria y de una simbiosis metabólica entre bacteria y arquea -sintrofia- (Gupta and Golding 1996; Margulis 1996; Ribeiro y Golding 1998; Zillig 1991; Gupta 1998; Martin and Muller 1998; Vellai et al. 1998; Moreira y Lopez-Garcia 1998; Lopez-Garcia y Moreira 1999; Lake y Rivera 1994; Sogin 1991; Cavalier-Smith 1987). Así que con esa similitud entre el núcleo eucariota y algunos virus complejos de ADN, Philip John Livingstone Bell, de la Universidad de Macquarie (Sidney, Australia), lanza una hipótesis distinta: un virus de ADN fue el origen del núcleo eucariota. Según su modelo, un virus de esas características tuvo una presencia persistente dentro de la célula antecesora a eucariotas y arqueas. Dado que el capping (añadir la caperuza al ARN mensajero) sólo se da en virus y eucariotas, sus enzimas sólo se encuentran en esos grupos y su origen cobra especial relevancia en el modelo de Bell. Ese ancestro vírico del núcleo debió ser un virus envuelto de ADN, similar a virus actuales como los poxvirus o el virus de la fiebre porcina africana (ASF, del inglés African Swine Fever Virus), salvo que el hospedador del virus fue una arquea. Y no cualquiera, tal y como se comenta en la discusión de Moreira y López-García, ese antecesor debió ser un tipo de mycoplasma perteneciente a la famila de las euriarqueotas metanogénicas, similar al sintrófico Methanoplasma elizabethii (Rose y Pirt, 1981). Como son virus con envuelta, se fusionarían las membranas y la partícula vírica, con su material genético y el equipo enzimático necesario, quedaría en su interior (Moss 1996). La arquea mencionada crece en filamentos ramificados, permitiendo un contacto íntimo con especies bacterianas productoras de hidrógeno y dióxido de carbono. La ausencia de pared celular permite, potencialmente, la infección por virus que utilizan la fusión de membranas como mecanismo de entrada (las bacterias tienen, en general, una pared bacteriana además de la membrana celular). Así que se propone que se estableció una infección persistente, una presencia persistente del virión en el citoplasma que sería un paso crucial en la eucariogénesis. Se ha observado que infecciones persistentes de poxvirus, como las observadas en las células de la eritroleucemia de Friend (Pogo y Friend, 1982), permiten el mantenimiento del virus en la célula durante varias generaciones de la célula sin integrarse en el genoma del hospedador. Genes del hospedador, como aquellos relacionados con el metabolismo de los nucleótidos y la traducción, pudieron incorporarse al genoma vírico de modo similar al que se incorporan resistencias a fármacos u otro tipo de genes que otorgan funciones varias. El virus “usurparía” esas funciones a la célula hospedadora.
Así que con esa similitud entre el núcleo eucariota y algunos virus complejos de ADN, Philip John Livingstone Bell, de la Universidad de Macquarie (Sidney, Australia), lanza una hipótesis distinta: un virus de ADN fue el origen del núcleo eucariota. Según su modelo, un virus de esas características tuvo una presencia persistente dentro de la célula antecesora a eucariotas y arqueas. Dado que el capping (añadir la caperuza al ARN mensajero) sólo se da en virus y eucariotas, sus enzimas sólo se encuentran en esos grupos y su origen cobra especial relevancia en el modelo de Bell. Ese ancestro vírico del núcleo debió ser un virus envuelto de ADN, similar a virus actuales como los poxvirus o el virus de la fiebre porcina africana (ASF, del inglés African Swine Fever Virus), salvo que el hospedador del virus fue una arquea. Y no cualquiera, tal y como se comenta en la discusión de Moreira y López-García, ese antecesor debió ser un tipo de mycoplasma perteneciente a la famila de las euriarqueotas metanogénicas, similar al sintrófico Methanoplasma elizabethii (Rose y Pirt, 1981). Como son virus con envuelta, se fusionarían las membranas y la partícula vírica, con su material genético y el equipo enzimático necesario, quedaría en su interior (Moss 1996). La arquea mencionada crece en filamentos ramificados, permitiendo un contacto íntimo con especies bacterianas productoras de hidrógeno y dióxido de carbono. La ausencia de pared celular permite, potencialmente, la infección por virus que utilizan la fusión de membranas como mecanismo de entrada (las bacterias tienen, en general, una pared bacteriana además de la membrana celular). Así que se propone que se estableció una infección persistente, una presencia persistente del virión en el citoplasma que sería un paso crucial en la eucariogénesis. Se ha observado que infecciones persistentes de poxvirus, como las observadas en las células de la eritroleucemia de Friend (Pogo y Friend, 1982), permiten el mantenimiento del virus en la célula durante varias generaciones de la célula sin integrarse en el genoma del hospedador. Genes del hospedador, como aquellos relacionados con el metabolismo de los nucleótidos y la traducción, pudieron incorporarse al genoma vírico de modo similar al que se incorporan resistencias a fármacos u otro tipo de genes que otorgan funciones varias. El virus “usurparía” esas funciones a la célula hospedadora.